Ullah I, Prévost J, Ladinsky MS, Stone H, Lu M, Anand SP, Beaudoin-Bussières G, Symmes K, Benlarbi M, Ding S, Gasser R, Fink C, Chen Y, Tauzin A, Goyette G, Bourassa C, Medjahed H, Mack M, Chung K, Wilen CB, Dekaban GA, Dikeakos JD, Bruce EA, Kaufmann DE, Stamatatos L, McGuire AT, Richard J, Pazgier M, Bjorkman PJ, Mothes W, Finzi A, Kumar P, Uchil PD. Live Imaging of SARS-CoV-2 Infection in Mice Reveals that Neutralizing Antibodies Require Fc Function for Optimal Efficacy. Immunity.doi : 10.1016/j.immuni.2021.08.015.
Les résultats et/ou conclusions contenus dans cette recherche ne reflètent pas nécessairement les opinions de tous les membres du GTIC.
Un partenariat international pluri-institutionnel, auquel participe le Pr Andrés Finzi, un chercheur de l’Université de Montréal financé par le GTIC, a démontré que les anticorps d’individus rétablis de la COVID-19 peuvent bloquer l’infection par le SRAS-CoV-2 et éviter une maladie grave dans les souris. Leur étude, financée partiellement par le GTIC, est désormais publiée dans Immunity.
Dans le cadre de cette étude, des souris ont été infectées par un virus SRAS-CoV-2 qui exprime des rapporteurs bioluminescents, ce qui permet de visualiser les tissus infectés chez l’animal vivant. Grâce à ce modèle de petits animaux, les chercheurs peuvent répondre aux questions qui resteraient autrement sans réponse, puisqu’il est impossible d’utiliser des sujets humains pour de telles études. Ils ont recouru à une technique qu’on appelle imagerie bioluminescente vivante pour prendre des photos à l’intérieur des souris afin de déterminer quels tissus sont infectés au fil du temps. Les souris étaient génétiquement modifiées pour exprimer le récepteur humain du SRAS-CoV-2 dans toutes leurs cellules, c’est-à-dire qu’elles pouvaient contracter une infection semblable à celle des humains.
Les chercheurs ont ensuite injecté des anticorps neutralisants à certaines souris, c’est-à-dire des anticorps provenant d’un donneur qui s’était rétabli de la COVID-19 faisant partie de la cohorte de l’équipe du CR-CHUM, et ils ont comparé les résultats à ceux de souris qui n’avaient reçu aucun traitement. Chez les souris qui n’avaient pas reçu d’anticorps, le SRAS-CoV-2 s’est propagé de la cavité nasale (le point d’infection) jusqu’aux poumons, puis a envahi divers organes, y compris le cerveau, pour finir par tuer les rongeurs. Les auteurs ont démontré que des souris à qui on avait administré des anticorps neutralisants avant de se faire injecter le SRAS-CoV-2 résistaient à l’infection. Dans une autre expérience, ils ont administré des traitements aux anticorps après l’infection pour déterminer leur mode d’action. Le traitement par anticorps neutralisants a également éliminé le virus lorsqu’il était administré dans les trois premiers jours suivant une infection établie. (Voir la figure 1.)
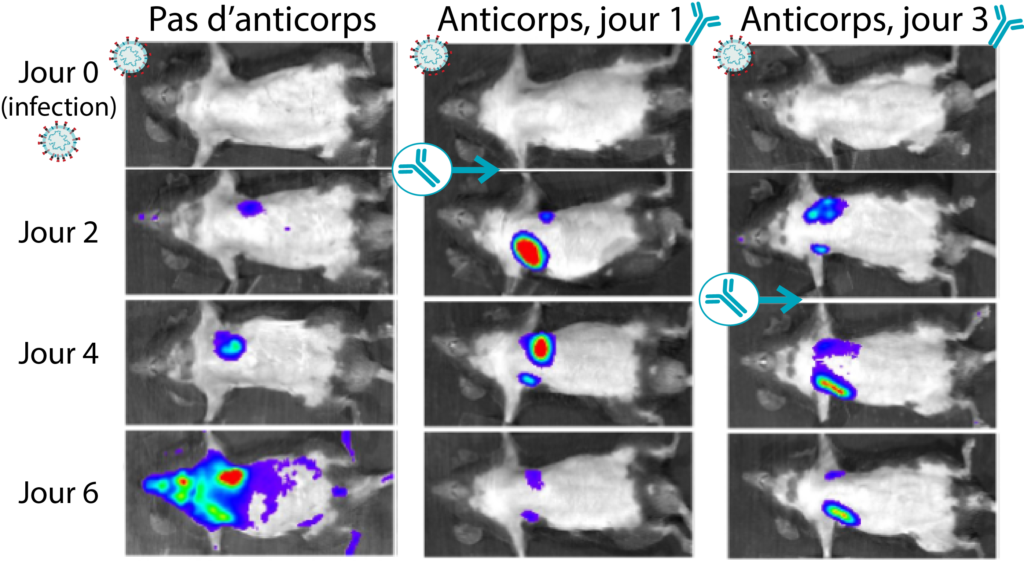
Figure 1 : Des souris transgéniques infectées par le virus du SRAS-CoV-2 bioluminescent étaient protégées après avoir reçu un traitement aux anticorps. On peut observer les tissus infectés selon l’intensité de la lumière qu’ils émettent (le violet désignant la plus petite quantité d’infection et le rouge, les secteurs les plus infectés). Cette figure ne présente que les souris qui n’avaient pas reçu de traitement ou à qui on avait injecté des anticorps neutralisants après avoir été infectées par le SRAS-CoV-2. Ainsi, les souris étaient infectées le jour 0 et recevaient soit aucun anticorps, soit un traitement aux anticorps le jour 1 ou 3 après l’infection. Pour chaque exemple relaté, les images du même animal sont prises le jour de l’infection (jour 0) et les jours 2, 4 et 6 suivant l’infection. Le jour 6, les tissus des animaux traités aux anticorps contenaient considérablement moins de virus que les animaux non traités. Image adaptée d’Ullah et coll. Autorisation d’utiliser cette image accordée par P. Uchil.
Enfin, les auteurs ont évalué les mécanismes qui interviennent dans le puissant effet antiviral des anticorps neutralisants. Ils ont conclu que ces anticorps ne se contentaient pas de neutraliser le SRAS-CoV-2. Dans leur article, ils ont expliqué en détail que, pour exercer pleinement leur capacité protectrice, ces anticorps doivent pouvoir interagir avec plusieurs types de cellules immunitaires, y compris les monocytes, les neutrophiles et les cellules tueuses naturelles (un mécanisme qu’on appelle fonctions effectrices à médiation Fc). Cette interaction s’imposait pour atténuer les réponses inflammatoires générales qui, en fait, peuvent aggraver la maladie. Les auteurs postulent que leur petit modèle animal peut être utilisé pour trouver des traitements antiviraux efficaces susceptibles d’être extrapolés rapidement en vue d’une application clinique chez les humains.

