Foire aux questions
Vous trouverez ci-dessous des définitions et des réponses aux questions les plus fréquentes sur la COVID-19.
Nous commençons par la base et répondons aux questions sur le virus et la maladie elle-même. Nous aborderons ensuite l’immunité et la réinfection, les vaccins contre la COVID-19, la surveillance des vaccins, qui porte sur l’efficacité et la sécurité des vaccins, puis la COVID longue. Nous expliquons également ce que sont exactement la séroprévalence et la sérosurveillance et pourquoi elles ont joué un rôle essentiel dans la réponse du Canada à la pandémie de COVID-19. Nous concluons en répondant à des questions sur les anticorps et sur le dépistage du SARS-CoV-2.
Si vous ne trouvez pas ce que vous cherchez ici, adressez-vous à votre autorité locale de santé publique pour obtenir des informations.

À propos du virus et de la maladie
Il existe différents types de coronavirus, dont certains provoquent des maladies. Bien qu’elles se traduisent généralement par des infections légères ou modérées des voies respiratoires supérieures, trois d’entre elles ont déclenché de dangereuses épidémies : le SARS-CoV (en 2002), le SRMO-CoV (en 2012) et le SARS-CoV-2 (en 2019).
 La morphologie (forme) du coronavirus est représentée ici par des protéines de spicule (en rouge) qui forment une couronne autour du virus. Les autres protéines représentées comprennent les protéines de l’enveloppe (jaune) et de la membrane (orange). Crédit photo : Alissa Eckert, MSMI, Dan Higgins, MAMS.
La morphologie (forme) du coronavirus est représentée ici par des protéines de spicule (en rouge) qui forment une couronne autour du virus. Les autres protéines représentées comprennent les protéines de l’enveloppe (jaune) et de la membrane (orange). Crédit photo : Alissa Eckert, MSMI, Dan Higgins, MAMS.
Le SARS-CoV est le virus responsable de l’épidémie de 2002, qui a débuté par des symptômes de type grippal, mais qui pouvait évoluer vers une pneumonie et une insuffisance respiratoire. L’épidémie a duré quelques mois.
Le SARS-CoV-2 est plus étroitement lié au SARS-CoV qu’au SRMO-CoV, avec une similarité génomique d’environ 80 %. Cependant, le SARS-CoV-2 peut pénétrer plus efficacement dans les cellules humaines et comprend des protéines qui n’ont pas d’équivalent dans le SARS-CoV, de sorte qu’ils ne sont pas totalement identiques.
Malgré leurs similitudes, l’épidémie de SARS-CoV s’est terminée alors que les vaccins en étaient aux premiers stades de leur développement, de sorte que des données détaillées sur les vaccins n’étaient pas disponibles avant la pandémie de SARS-CoV-2. Toutefois, les enseignements biologiques et cliniques fondamentaux tirés des épidémies de SARS-CoV et de SRMO ont constitué des éléments importants pour la mise au point d’éventuels vaccins contre le SARS-CoV-2.
Les variants du SARS-CoV-2 apparaissent lorsque le code génétique du virus original subit des modifications ou des mutations. Ces changements se produisent au fil du temps comme un sous-produit de la réplication virale. L’Organisation mondiale de la santé (OMS) suit les variants du SARS-CoV-2 dans le monde entier et les désigne comme des variants préoccupants (VP) lorsqu’ils se propagent beaucoup plus rapidement, sont plus aptes à infecter les gens, provoquent des maladies plus graves ou réduisent l’efficacité des vaccins et des traitements. Au Canada, le Coronavirus Variants Rapid Response Network (CoVaRR-Net), c’est-à-dire le Réseau de réponse rapide aux variants du coronavirus, suit les variants et étudie ceux qui se propagent plus rapidement, sont plus transmissibles et provoquent des symptômes plus graves.
Au 31 mars 2024, l’OMS avait désigné cinq VP : Alpha, Beta, Gamma, Delta et Omicron. Omicron est apparu en novembre 2021 et s’est propagé plus rapidement que le virus SARS-CoV-2 original et les variants précédents. Au printemps 2024, le variant Omicron présentait plus de 50 mutations connues, dont 32 dans la protéine du spicule, ce qui a facilité sa transmission.
Le variant Omicron et ses premiers sous-variants (BA.1, BA.2, BA.3, BA.4, BA.5) ont contribué à l’augmentation massive des infections au sein de la population canadienne et dans d’autres parties du monde à partir du début de l’année 2022.
L’OMS suit également les variants d’intérêt (VI), définis comme des variants présentant des mutations susceptibles d’accroître la transmissibilité, la gravité de la maladie, l’évasion des anticorps, de réduire la sensibilité aux traitements et qui semblent présenter un avantage en termes de croissance par rapport à d’autres variants en circulation. Au 9 février 2024, il y avait cinq VI Omicron : XBB.1.5, XBB.1.16, EG.5, BA.2.86 et JN.1. En mars 2024, JN.1 était le variant du SARS-CoV-2 le plus largement répandu. À l’époque, rien n’indiquait qu’il provoquait des maladies plus graves.
En mars 2024, la souche originale du SARS-CoV-2 ne circule plus et Omicron est devenu le variant le plus répandu.
En général, les infections par Omicron entraînent moins d’hospitalisations, des maladies moins graves et un taux plus élevé de cas asymptomatiques, car il n’a pas tendance à infecter les voies respiratoires inférieures.
Bien qu’Omicron soit un variant moins mortel du SARS-CoV-2, il a causé plus de décès au Canada que tout autre variant en raison du nombre très élevé de personnes infectées. En 2022, la COVID-19 était la troisième cause de décès au Canada, contribuant en grande partie à la perte moyenne d’un an de l’espérance de vie au Canada.
Les symptômes d’une infection par Omicron ressemblent à ceux rapportés précédemment pour la COVID-19 : fièvre, toux, maux de gorge, fatigue et maux de tête sont les plus fréquents. Les personnes présentant des symptômes similaires à ceux de la COVID-19 doivent s’isoler.
Le vendredi 5 mai 2023, l’Organisation mondiale de la santé (OMS) a déclaré que la COVID-19 n’était plus une urgence de santé publique de portée internationale. Cependant, elle reste une menace pour la santé mondiale.
La décision de l’OMS se fonde sur des données qui montrent que, dans les 12 mois précédant sa décision, la pandémie était en recul, avec une baisse des taux de mortalité et une diminution de la pression sur les systèmes de santé.
Cependant, la COVID-19 existe toujours et de nouvelles mutations continuent d’apparaître. Il est donc important de continuer à recevoir des doses de rappel et de respecter les mesures de santé publique. Bien que la plupart des personnes ne tombent pas gravement malades ou ne meurent pas à cause du variant Omicron, celui-ci peut néanmoins entraîner des décès ou des hospitalisations et doit être pris au sérieux.
De plus, la COVID longue est une préoccupation majeure pour de nombreuses personnes qui ont été infectées par le SARS-CoV-2. Son impact sur la santé des personnes et sur le système de soins de santé est encore à l’étude.
- Faites-vous vacciner selon les recommandations de l’autorité sanitaire locale dès qu’elles sont disponibles.
- Évitez les foules et les contacts étroits lorsque c’est possible et réalisable.
- Si vous ne pouvez pas éviter les foules ou si vous vous trouvez dans un endroit mal ventilé, portez un masque.
- Lavez-vous les mains fréquemment, mais surtout avant de toucher vos yeux ou votre bouche.
- Lorsque vous éternuez, couvrez-vous la bouche avec votre coude ou un mouchoir en papier.
- Isolez-vous en cas de résultat positif au test de dépistage de la COVID-19.
- Nettoyez et désinfectez les surfaces les plus fréquemment touchées (poignées de porte, robinets, téléphones).

Immunité et réinfection
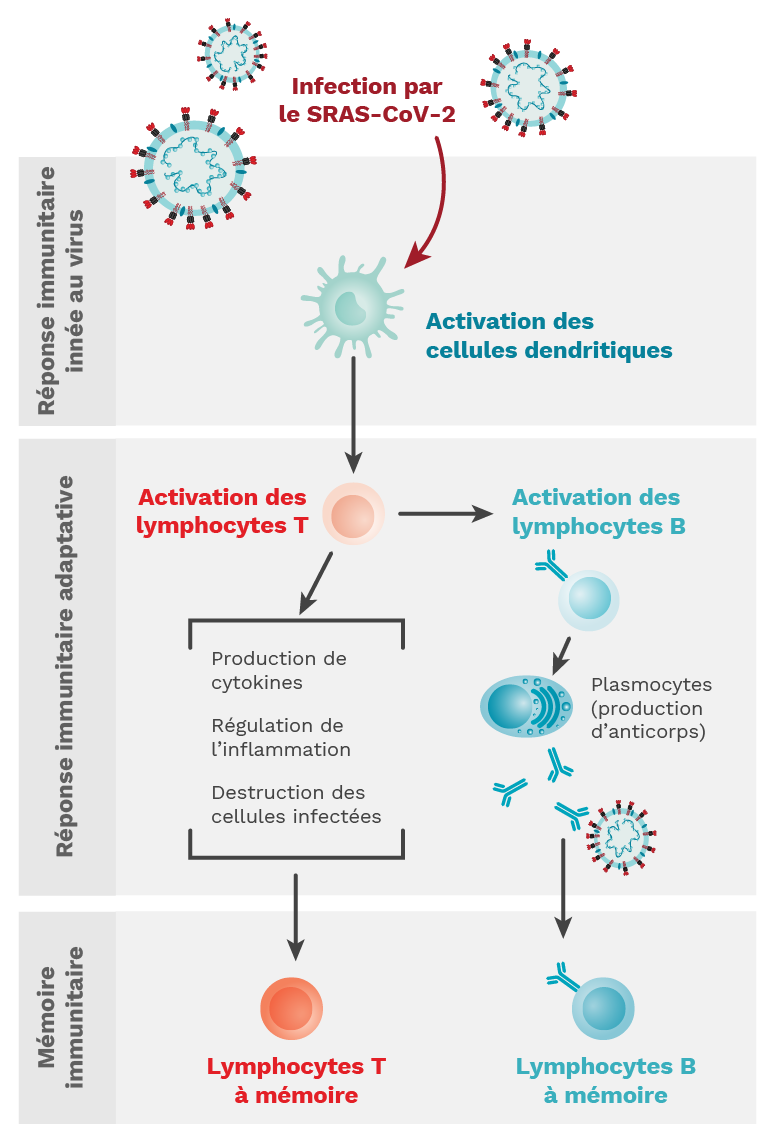
Figure 1.1. Lorsqu’un individu est infecté par le SARS-CoV-2, la réponse immunitaire innée est déclenchée et caractérisée par l’activation des cellules dendritiques (CD). Il s’ensuit une réponse immunitaire adaptative au cours de laquelle les lymphocytes T et B sont activés. Les lymphocytes T peuvent remplir de nombreuses fonctions différentes, tandis que les lymphocytes B se différencient en plasmocytes pour produire des anticorps. Les deux types de cellules établissent des populations mémoires pour prévenir la réinfection. Crédit photo : Mariana Bego.
L’immunité acquise par l’infection est proportionnelle à la gravité de l’infection. Les personnes atteintes d’une infection grave présentent des concentrations d’anticorps plus élevées et donc une réponse immunitaire humorale plus forte qui peut durer des mois (1, 2). En revanche, les personnes souffrant d’une infection légère ne sont pas protégées très longtemps, car leur concentration en anticorps est plus faible (1, 2).
Les réponses immunitaires protectrices contre l’infection par le SARS-CoV-2 se composent de deux mécanismes principaux : l’immunité humorale (à médiation par les anticorps) et l’immunité cellulaire (à médiation par les lymphocytes T, entre autres globules blancs). Dans l’ensemble, les études montrent que l’immunité est de courte durée et que les individus ont donc besoin d’une dose de rappel après l’infection.
En 2024, les scientifiques avaient trouvé de solides données probantes montrant que la concentration d’anticorps IgG contre la protéine de spicule du SARS-CoV-2 et le niveau d’anticorps neutralisants contre le SARS-CoV-2 sont des « corrélats de protection » pour les vaccins contre la COVID-19 symptomatique (3).
Immunité humorale (à médiation par les anticorps) :
- Les lymphocytes B producteurs d’anticorps augmentent au cours du premier mois et restent nombreux pendant au moins huit mois après l’infection (4, 5, 6, 7).
- Les anticorps IgA contre le domaine de liaison du récepteur du SARS-CoV-2, développés dans le nez et la gorge, diminuent rapidement après l’infection. Ils atteignent leur maximum entre 16 et 20 jours et commencent à diminuer un mois après l’infection (8 à 10), mais les IgA neutralisantes peuvent rester détectables dans la salive jusqu’à 73 jours après l’infection (10).
- Les anticorps IgG contre le spicule du SARS-CoV-2 sont plus durables et restent détectables jusqu’à 12 mois après l’infection (11).
- Les anticorps neutralisants contre le SARS-CoV-2 (anticorps qui arrêtent la réplication du SARS-CoV-2 en affectant la façon dont les molécules à la surface du pathogène peuvent pénétrer dans les cellules du corps) et peuvent durer jusqu’à 10 mois après l’infection (7).
L’immunité cellulaire (à médiation par les lymphocytes T, entre autres globules blancs) :
- Le SARS-CoV-2 entraîne également une immunité à médiation cellulaire en activant les lymphocytes T CD4 et cytotoxiques spécifiques du SARS-CoV-2. Une étude a montré que les réponses des lymphocytes T mémoires amorcées par l’infection virale initiale peuvent conserver une forte réactivité croisée pendant deux ans (12).
Références
- Röltgen K, Powell AE, Wirz OF, Stevens BA, Hogan CA, Najeeb J, Hunter M, Wang H, Sahoo MK, Huang C, Yamamoto F, Manohar M, Manalac J, Otrelo-Cardoso AR, Pham TD, Rustagi A, Rogers AJ, Shah NH, Blish CA, Cochran JR, Jardetzky TS, Zehnder JL, Wang TT, Narasimhan B, Gombar S, Tibshirani R, Nadeau KC, Kim PS, Pinsky BA, Boyd SD. Defining the features and duration of antibody responses to SARS-CoV-2 infection associated with disease severity and outcome. Sci Immunol. 7 déc. 2020;5(54):eabe0240. doi: 10.1126/sciimmunol.abe0240.
- He Z, Ren L, Yang J, Guo L, Feng L, Ma C, et al. Seroprevalence and humoral immune durability of anti-SARS-CoV-2 antibodies in Wuhan, China: a longitudinal, population-level, cross-sectional study. 2021;397(10279):1075- 84.
- Gilbert PB, Donis RO, Koup RA, Fong Y, Plotkin SA, Follmann D. A Covid-19 Milestone Attained – A Correlate of Protection for Vaccines. N Engl J Med. 10 déc. 2022. doi : 10.1056/NEJMp2211314.
- Dan JM, Mateus J, Kato Y, Hastie KM, Yu ED, Faliti CE, Grifoni A, Ramirez SI, Haupt S, Frazier A, Nakao C, Rayaprolu V, Rawlings SA, Peters B, Krammer F, Simon V, Saphire EO, Smith DM, Weiskopf D, Sette A, Crotty S. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. 5 déc.2021 Feb 5;371(6529):eabf4063. doi: 10.1126/science.abf4063.
- Lumley SF, Wei J, O’Donnell D, Stoesser NE, Matthews PC, Howarth A, Hatch SB, Marsden BD, Cox S, James T, Peck LJ, Ritter TG, de Toledo Z, Cornall RJ, Jones EY, Stuart DI, Screaton G, Ebner D, Hoosdally S, Crook DW, Conlon CP, Pouwels KB, Walker AS, Peto TEA, Walker TM, Jeffery K, Eyre DW; Oxford University Hospitals Staff Testing Group. The Duration, Dynamics, and Determinants of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Antibody Responses in Individual Healthcare Workers. Clin Infect Dis. 2 août 2021;73(3):e699-e709. doi: 10.1093/cid/ciab004.
- Cohen KW, Linderman SL, Moodie Z, Czartoski J, Lai L, Mantus G, Norwood C, Nyhoff LE, Edara VV, Floyd K, De Rosa SC, Ahmed H, Whaley R, Patel SN, Prigmore B, Lemos MP, Davis CW, Furth S, O’Keefe JB, Gharpure MP, Gunisetty S, Stephens K, Antia R, Zarnitsyna VI, Stephens DS, Edupuganti S, Rouphael N, Anderson EJ, Mehta AK, Wrammert J, Suthar MS, Ahmed R, McElrath MJ. Longitudinal analysis shows durable and broad immune memory after SARS-CoV-2 infection with persisting antibody responses and memory B and T cells. Cell Rep Med. 2021 Jul 20;2(7):100354. doi: 10.1016/j.xcrm.2021.100354.
- Dulipsingh L, Schaefer EJ, Wakefield D, Williams K, Halilovic A, Crowell R. Comparing SARS-CoV-2 neutralizing antibody levels in convalescent unvaccinated, convalescent vaccinated, and naive vaccinated subjects. Heliyon. 2023 Jun;9(6):e17410. doi: 10.1016/j.heliyon.2023.e17410. Epub 17 juin 2023. PMID: 37366522 ; PMCID : PMC10276490.
- Ma H, Zeng W, He H, Zhao D, Jiang D, Zhou P, Cheng L, Li Y, Ma X, Jin T. Serum IgA, IgM, and IgG responses in COVID-19. Cell Mol Immunol. 17 juil. 2020 (7):773-775. doi: 10.1038/s41423-020-0474-z.
- Beaudoin-Bussières G, Laumaea A, Anand SP, Prévost J, Gasser R, Goyette G, Medjahed H, Perreault J, Tremblay T, Lewin A, Gokool L, Morrisseau C, Bégin P, Tremblay C, Martel-Laferrière V, Kaufmann DE, Richard J, Bazin R, Finzi A. Decline of Humoral Responses against SARS-CoV-2 Spike in Convalescent Individuals. mBio. 16 juil. 2020;11(5): e02590 -20. doi: 10.1128/mBio.02590-20.
- Sterlin D, Mathian A, Miyara M, Mohr A, Anna F, Claër L, Quentric P, Fadlallah J, Devilliers H, Ghillani P, Gunn C, Hockett R, Mudumba S, Guihot A, Luyt CE, Mayaux J, Beurton A, Fourati S, Bruel T, Schwartz O, Lacorte JM, Yssel H, Parizot C, Dorgham K, Charneau P, Amoura Z, Gorochov G. IgA dominates the early neutralizing antibody response to SARS-CoV-2. Sci Transl Med. 2021 Jan 20;13(577):eabd2223. doi: 10.1126/scitranslmed.abd2223. Epub 7 déc. 2020. PMID: 33288662 ; PMCID : PMC7857408.
- Sarjomaa M, Diep LM, Zhang C, Tveten Y, Reiso H, Thilesen C, Nordbø SA, Berg KK, Aaberge I, Pearce N, Kersten H, Vandenbroucke JP, Eikeland R, Fell AKM. SARS-CoV-2 antibody persistence after five and twelve months: A cohort study from South-Eastern Norway. PLoS One. 10 août 2022;17(8):e0264667. doi: 10.1371/journal.pone.0264667. PMID: 35947589 ; PMCID : PMC9365168.
- Guo PL, Zhang Q, Gu X, Ren PL, Huang T, Li Y. Durability and cross-reactive immune memory to SARS-CoV-2 in individuals 2 years after recovery from COVID-19 : a longitudinal cohort study. The Lancet. 5 janv. 2024 (1):e24-e33. doi: https://doi.org/10.1016/S2666-5247(23 ) 00255 -0.
La réponse courte est non. Le fait d’être infecté par le SARS-CoV-2 ne garantit pas que vous ne puissiez pas être réinfecté.
Toutefois, le fait d’avoir déjà été infecté, en particulier si l’on est symptomatique, confère une certaine protection contre les infections ultérieures, en particulier contre les variants ancestraux Alpha, Beta et Delta du SARS-CoV-2. Cet effet protecteur s’est avéré nettement plus faible contre les variants Omicron, bien que la protection contre la forme grave de la maladie ou le décès en cas de réinfection soit restée élevée. La protection s’estompe avec le temps, mais elle est probablement similaire à celle d’une personne ayant reçu deux doses d’un vaccin à ARNm.
De nombreux facteurs influencent la réponse immunitaire d’un individu à une infection. Plusieurs études financées par le GTIC ont porté sur des populations particulièrement vulnérables en raison d’un déficit immunitaire causé par une maladie (p. ex. maladie inflammatoire de l’intestin ou autres maladies auto-immunes) ou d’un traitement pour d’autres maladies (p. ex. greffés d’organes pleins, patients atteints de cancer). Dans de nombreux cas, la maladie était plus grave, mais la protection immunitaire n’était pas nécessairement plus importante.
Le degré de protection acquis par l’infection reste donc un domaine de recherche actif. Selon les données du printemps 2024, les vaccins sont les plus efficaces contre Omicron.
Comme pour les coronavirus saisonniers responsables du rhume, la guérison d’une infection initiale par le SARS-CoV-2 confère un certain degré d’immunité et de protection contre la réinfection. Cependant, des réinfections se produisent. Chez la plupart des personnes en bonne santé, les réinfections ont tendance à être moins graves que l’infection initiale.
Plusieurs facteurs influencent l’impact d’une réinfection, notamment le variant à l’origine de la réinfection, l’état de santé de la personne (conditions préexistantes/troubles comorbides), ses antécédents de vaccination, son âge, le temps écoulé depuis l’infection précédente et la gravité de la première infection par le SARS-CoV-2.
Les deux principales raisons des vagues de réinfections les plus récentes (au printemps 2024) sont les nouveaux sous-variants et l’affaiblissement de l’immunité.
Le variant Omicron, apparu en novembre 2021, présente une transmissibilité et une infectivité accrues, ce qui se traduit par des réinfections plus fréquentes. En outre, au fur et à mesure que le temps passe après l’infection ou la vaccination, l’immunité des anticorps commence à s’affaiblir.
C’est pourquoi les experts recommandent actuellement de se tenir à jour en matière de vaccination et de prendre des précautions supplémentaires telles que le lavage fréquent des mains et le port d’un masque le cas échéant (p. ex., dans les lieux très fréquentés où la ventilation est réduite).
Une infection postvaccinale se produit lorsque des personnes entièrement vaccinées contre une maladie, comme la COVID-19, sont infectées par la suite. Le terme « postvaccinale » ici signifie que le virus a franchi la barrière protectrice que constituent les vaccins. L’efficacité des vaccins contre la COVID-19 n’est pas de 100 % et, par conséquent, des infections peuvent se produire, bien qu’elles soient principalement asymptomatiques ou légèrement symptomatiques. Les vaccins contre la COVID-19 restent le meilleur moyen d’être protégé contre la forme grave de la maladie, les hospitalisations et les décès résultant d’une infection par le SARS-CoV-2.
Il existe plusieurs permutations de l’immunité hybride, en fonction du type de vaccin, du nombre de doses vaccinales, du variant spécifique du SARS-CoV-2 et du moment de l’infection – si elle s’est produite avant ou après la dernière dose vaccinale d’une personne. Toutes ces variables influencent les niveaux d’anticorps et les réponses immunitaires qui en résultent.
Cela ne signifie pas pour autant qu’il faille essayer d’être infecté par le SARS-CoV-2, car il existe des risques de souffrir d’une forme grave de la maladie et de complications, notamment le syndrome post-aigu de la COVID-19 (également connu sous le nom de COVID longue). Les personnes doivent plutôt faire preuve de prudence pour éviter d’être infectées et continuer à recevoir des doses de rappel pour compenser l’affaiblissement de l’immunité.
Résumé des résultats d’études spécifiques sur l’immunité hybride :
- Pendant la période pré-Omicron, l’immunité acquise par la vaccination a assuré une protection de plus de 90 % (après deux doses de vaccin) contre la réinfection. La protection ne s’est pas affaiblie plus d’un an après l’infection ou plus de six mois après la vaccination (1).
- Au cours de la période pré-Omicron, les personnes ayant reçu deux doses de vaccin et ayant contracté une infection antérieure avaient un risque de réinfection inférieur de 66 % à celui des personnes n’ayant qu’une immunité acquise par l’infection (2).
- Les personnes précédemment infectées ont vu leur taux d’anticorps diminuer plus lentement après la vaccination que les personnes vaccinées, mais jamais infectées ou infectées et jamais vaccinées (3).
- Des études plus récentes menées après la propagation d’Omicron ont également montré que l’immunité hybride confère une forte protection contre l’infection par Omicron et soulignent l’importance de maintenir les doses de rappel (4).
Page GTIC : Recherche sur l’immunité hybride
- Hall V, Foulkes S, Insalata F, Kirwan P, Saei A, Atti A, Wellington E, Khawam J, Munro K, Cole M, Tranquillini C, Taylor-Kerr A, Hettiarachchi N, Calbraith D, Sajedi N, Milligan I, Themistocleous Y, Corrigan D, Cromey L, Price L, Stewart S, de Lacy E, Norman C, Linley E, Otter AD, Semper A, Hewson J, D’Arcangelo S, Chand M, Brown CS, Brooks T, Islam J, Charlett A, Hopkins S; SIREN Study Group. Protection against SARS-CoV-2 after Covid-19 Vaccination and Previous Infection. N Engl J Med. 31 mars 2022;386(13):1207-1220. doi: 10.1056/NEJMoa2118691.
- Nordström P, Ballin M, Nordström A. Risk of SARS-CoV-2 reinfection and COVID-19 hospitalisation in individuals with natural and hybrid immunity: a retrospective, total population cohort study in Sweden. Lancet Infect Dis. 22 juin 2022 (6):781-790. doi: 10.1016/S1473-3099(22)00143-8.
- Nordström P, Ballin M, Nordström A. Risk of SARS-CoV-2 reinfection and COVID-19 hospitalisation in individuals with natural and hybrid immunity : a retrospective, total population cohort study in Sweden. Lancet Infect Dis. 22 juin 2022 (6):781-790. doi: 10.1016/S1473-3099(22)00143-8.
- Cauchi JP, Dziugyte A, Borg ML, Melillo T, Zahra G, Barbara C, Souness J, Agius S, Calleja N, Gauci C, Vassallo P, Baruch J. Hybrid immunity and protection against infection during the Omicron wave in Malta. Emerg Microbes Infect. 12 déc. 2023 (1):e2156814. doi: 10.1080/22221751.2022.2156814. PMID: 36510837 ; PMCID : PMC9817114.
En mars 2023, la plupart des Canadiens avaient acquis des anticorps contre le SARS-CoV-2, soit par infection, soit par vaccination.
Bien que notre Séroprévalence au Canada n’indique pas spécifiquement le pourcentage de Canadiens ayant une immunité hybride, elle indique le pourcentage d’anticorps acquis par l’infection et le pourcentage d’anticorps acquis par l’infection ou induits par la vaccination. En décembre 2023, ~81 % des Canadiens avaient des anticorps acquis par l’infection, la plupart des infections s’étant produites pendant la vague Omicron.
La COVID-19 provoque divers degrés de maladie, allant d’une infection asymptomatique (aucun symptôme apparent) à des symptômes plus légers, en passant par une pneumonie grave, un accident vasculaire cérébral, une septicémie, une défaillance d’organe, voire la mort. On estime qu’environ 1 personne infectée sur 5 ne présente aucun symptôme, bien que ce chiffre soit très variable en fonction de la population étudiée.
Il est important de faire la différence entre les infections asymptomatiques et pré-symptomatiques. Une personne asymptomatique ne développe jamais de symptômes, depuis le moment où elle a contracté le virus jusqu’à la disparition complète de l’infection. Le terme « pré-symptomatique » désigne une personne qui finira par présenter des symptômes.
Au cours de la pandémie, la période d’incubation est passée de 7 à 10 jours à de 3 à 4 jours.
Bien que la probabilité de transmission du virus soit beaucoup plus élevée chez les personnes symptomatiques, l’infection asymptomatique joue également un rôle dans la propagation de la COVID-19.
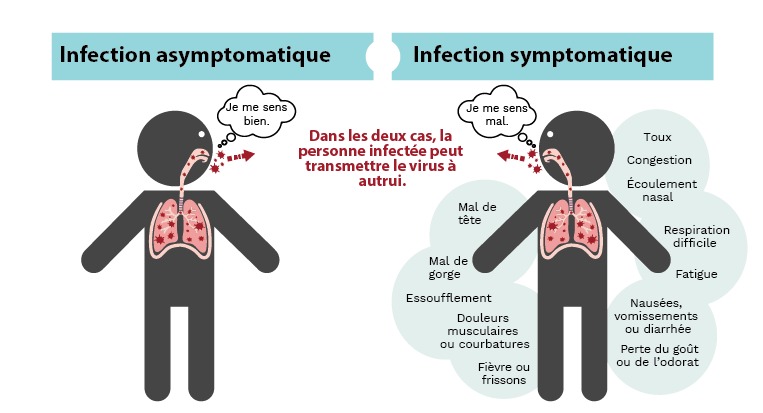
L’infection par le SARS-CoV-2 peut entraîner un large éventail de symptômes tels que fièvre, frissons et perte de goût ou d’odorat (panneau de droite), ou passer totalement inaperçue sans aucun symptôme (asymptomatique, panneau de gauche). Dans les deux cas, les personnes infectées peuvent transmettre le virus à d’autres personnes. Crédit d’image : Kristin Davis.
Cependant, l’efficacité des anticorps peut diminuer et varier en fonction des mutations des virus. Il est donc préférable de suivre les directives les plus récentes de votre autorité sanitaire locale. (Figure 1.1)
Outre la production d’anticorps contre le SARS-CoV-2, les vaccins contre la COVID-19 activent également l’immunité à médiation cellulaire.
Les lymphocytes T sont un élément important de la réponse immunitaire mise en place par notre organisme en réaction à des agents pathogènes tels que le SARS-CoV-2. Il existe plusieurs sous-types de lymphocytes T qui réagissent à différents types d’agents pathogènes et qui jouent un rôle essentiel dans l’élaboration de la réponse immunitaire globale. Les lymphocytes T ont à leur surface des protéines capables de détecter et de tuer les cellules infectées par le SARS-CoV-2. Ils peuvent également libérer un large éventail de petites molécules solubles (cytokines) qui peuvent recruter d’autres cellules immunitaires pour aider à éliminer l’infection. Les lymphocytes T influencent également la réponse anticorps contre le SARS-CoV-2 en façonnant le type d’anticorps générés contre le virus. Enfin, une fois l’infection éliminée, les lymphocytes T s’établissent comme une petite population mémoire qui est préparée et prête à réagir à toute nouvelle exposition au SARS-CoV-2, protégeant ainsi contre toute infection ultérieure qui pourrait survenir.
Outre l’immunité à médiation cellulaire, l’immunité à médiation par les anticorps est également un élément essentiel de la réponse immunitaire protectrice. L’immunité à médiation par les anticorps, également appelée immunité humorale, fait intervenir des macromolécules. Il s’agit notamment des protéines du complément, des peptides antimicrobiens et des anticorps sécrétés. L’immunité humorale est principalement assurée par des lymphocytes B, qui produisent des anticorps.
Il a été démontré que les vaccins contre la COVID-19 activent l’immunité à médiation par les anticorps et contribuent à la production d’anticorps contre le virus du SARS-CoV-2.
Après avoir reçu un vaccin contre la COVID-19 ou s’être remis d’une infection par le SARS-CoV-2, le système immunitaire reste « préparé » à l’exposition ou à la réexposition au virus. Les cellules immunitaires qui ont reconnu et guéri l’infection initiale par le SARS-CoV-2 ou, dans le cas d’un vaccin, qui ont reconnu les parties du virus du SARS-CoV-2 incluses dans la formule vaccinale, établissent des populations de cellules mémoires de longue durée qui sont prêtes à réagir rapidement à un virus.
Une analyse à long terme a montré que l’affaiblissement de la réponse anticorps après la vaccination se caractérise par deux éléments :
- Une décroissance initiale rapide après le pic de réponse
- Une décroissance stabilisée plus lente, suggérant que les anticorps peuvent être de longue durée
Cette étude suggère que ce n’est probablement pas l’affaiblissement de l’immunité des anticorps, mais la mutation du virus pour échapper au système immunitaire qui est à l’origine de la plupart des nouvelles infections dans les populations vaccinées.
Des données (sept. 2023-janv. 2024) du CDC suggèrent que les vaccins contre la COVID-19 disponibles étaient efficaces contre les nouveaux variants d’Omicron, y compris JN.1.

Vaccins contre la COVID-19
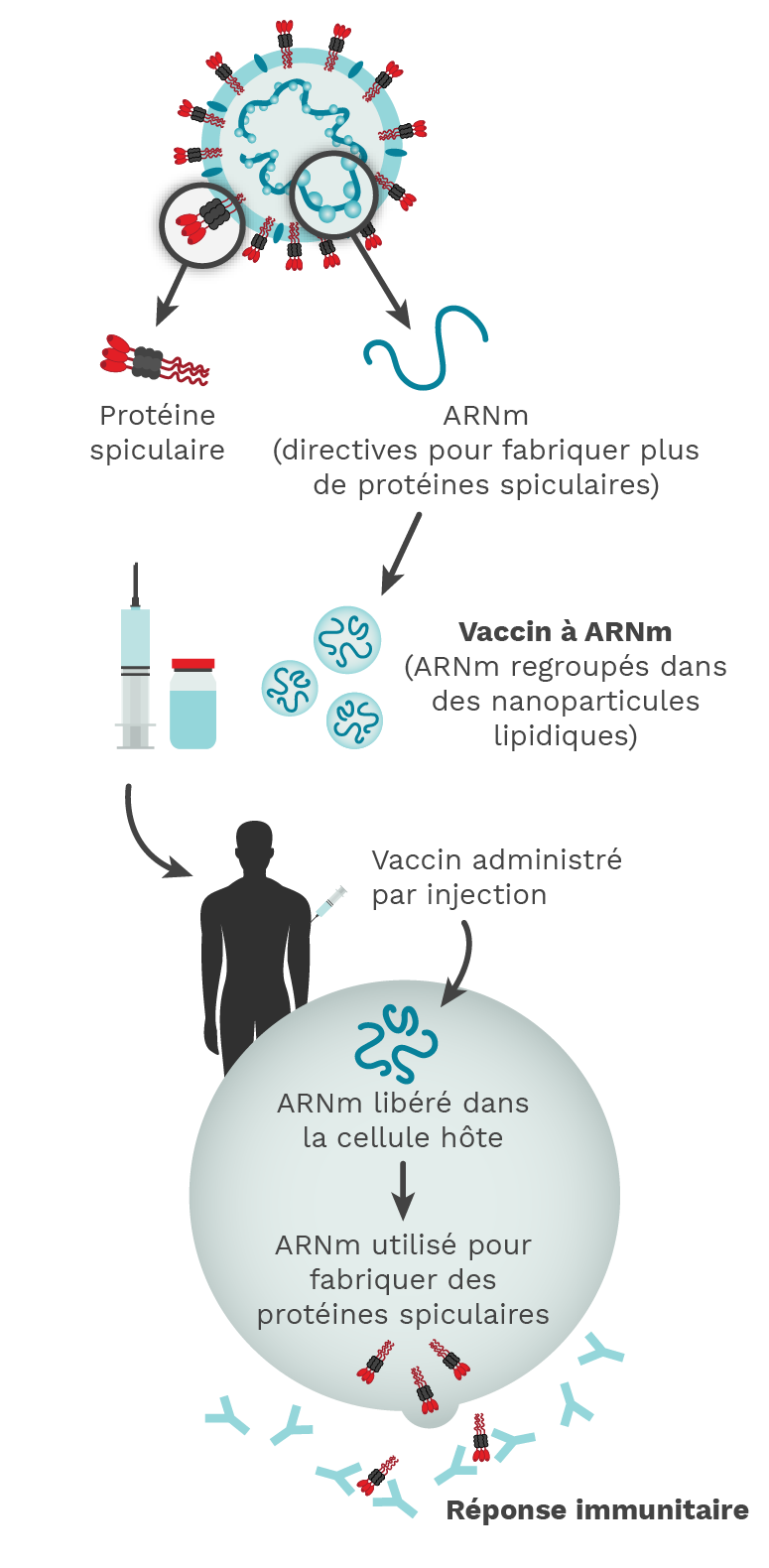
Figure 2.1. Le vaccin à ARNm contre la COVID-19 contient des instructions (ARNm) nécessaires à la fabrication d’un grand nombre de protéines de spicule du SARS-CoV-2. La libération de cette protéine en dehors de la cellule hôte déclenche une réponse immunitaire et l’hôte produit des anticorps, des lymphocytes B et des lymphocytes T contre le virus, comme dans le cas d’une infection naturelle. Crédit photo : Mariana Bego.
L’immunité induite par la vaccination a tendance à s’estomper avec le temps, c’est pourquoi il est important de recevoir des doses de rappel contre la COVID-19. Le Comité consultatif national de l’immunisation (CCNI) met à jour ses recommandations plusieurs fois par an. Au moment de la rédaction du présent rapport, les autorités avaient mis à jour leurs recommandations en mai 2024, suggérant que tous les Canadiens âgés de plus de six mois reçoivent une dose de rappel avec la dernière souche sélectionnée à l’automne 2024. Voir leurs orientations pour l’automne 2024 ici.
- Vaccins à ARNm
Les vaccins à base d’ARNm, tels que ceux créés par Pfizer-BioNTech et Spikevax de Moderna, contiennent de l’ARNm qui code pour la protéine de spicule du SARS-CoV-2. Au début de la pandémie, cela a été fait pour la souche originale du SARS-CoV-2, mais depuis lors, l’ARNm choisi a été orienté vers les protéines des variants plus récents qui suscitent des inquiétudes.
Grâce à la vaccination, l’ARNm est transmis aux cellules, qui sont alors capables de produire la protéine virale et d’engager le système immunitaire, en le préparant à reconnaître rapidement le virus vivant au moment de l’exposition. Matrix-M est un nouvel adjuvant à base de saponine qui facilite l’activation des cellules du système immunitaire inné, ce qui augmente l’ampleur de la réponse immunitaire spécifique à la protéine du spicule.
- Vaccins à sous-unités protéiques
Les vaccins à sous-unités protéiques, tels que les vaccins Novavax, sont constitués de protéines inoffensives du virus du SARS-CoV-2, plus précisément d’une nanoparticule de protéine de spicule recombinante du SARS-CoV-2 purifiée et complète coformulée avec l’adjuvant Matrix-M.
Tous les types de vaccins ont le même objectif : générer un stock de lymphocytes B et T mémoires qui se rappelleront comment combattre le virus à l’avenir. (Figure 2.1)
Plusieurs vaccins contre la COVID-19 sont approuvés et autorisés au Canada (voir tableau ci-dessous). Ces renseignements ont été obtenus auprès du Gouvernement du Canada dont la page Web contient plus de détails sur le délai entre les doses, le volume des doses et les recommandations spécifiques pour les populations immunodéprimées. Ce tableau a été mis à jour pour la dernière fois en mars 2024.
| Nom de marque | Fabricant(s) | Nom de la recherche | Type de vaccin | Doses disponibles | Approuvé pour |
| ComirnatyMD Omicron XBB.1.5 | Pfizer et BioNTech Manufacturing GmbH | Raxtozinameran | Vaccin à ARNm (ARNm contre la protéine de spicule du variant Omicron XBB.1.5) |
3 mcg 10 mcg 30 mcg |
6 mois à < 5 ans (3 mcg) 5 à 11 ans (10 mcg) 12 ans et plus (30 mcg) |
| ComirnatyMD Original et Omicron BA.4/BA.5 | Pfizer et BioNTech Manufacturing GmbH | Tozinameran/Famtozinameran, Bivalent | Vaccin ARNm, bivalent (la moitié de l’ARNm code pour la protéine de spicule de la souche originale, l’autre moitié pour les variants Omicron BA.4/5) |
10 mcg 30 mcg |
6 mois à 4 ans (3 mcg) 5 à 11 ans (10 mcg) 12 ans et plus (30 mcg) |
| SpikevaxMD XBB.1.5 | Moderna | Andusomeran | Vaccin à ARNm (ARNm contre la protéine de spicule du variant XBB.1.5) |
25 mcg 50 mcg |
6 mois à 11 ans (25 mcg) 12 ans et plus (50 mcg) |
| NuvaxovidMC | Novavax | S/O | Vaccin contre les sous-unités protéiques (contre la protéine de spicule de la souche originale) | 5 mcg | 12 ans et plus 18 ans et plus (comme dose de rappel) |
| Nuvaxovid XBB.1.5 | Novavax | S/O | Vaccin contre les sous-unités protéiques (protéine de spicule XBB recombinante.1.5 prémélangée à la Matrix M) | 5 mcg | 12 ans et plus |
En plus de ces vaccins, des traitements à base d’anticorps monoclonaux ont également été autorisés pour la prophylaxie pré-exposition à la COVID19 :
EVUSHELDMC (tixagevimab et cilgavimab), AstraZeneca Canada Inc. Utilisation autorisée chez les personnes âgées de 12 ans et plus pesant au moins 40 kg (300 µg de tixagevimab et 300 µg de cilgavimab administrés successivement).
Comme les recommandations relatives au vaccin contre la COVID-19 varient d’une province à l’autre, consultez les sites Web provinciaux suivants pour obtenir de plus amples renseignements.
Colombie-Britannique : https://www2.gov.bc.ca/gov/content/covid-19/vaccine/plan
Alberta : https://www.alberta.ca/covid19-vaccine.aspx
Manitoba : https://www.gov.mb.ca/covid19/vaccine.html
Ontario : https://www.ontario.ca/page/covid-19-vaccines#booster-doses
Québec : https://www.quebec.ca/sante/conseils-et-prevention/vaccination/vaccin-contre-la-covid-19
Nouveau-Brunswick : https://www2.gnb.ca/content/gnb/en/corporate/promo/covid-19/nb-vaccine.html
Nouvelle-Écosse : https://www.nshealth.ca/coronavirusvaccine
Île-du-Prince-Édouard : https://www.princeedwardisland.ca/en/information/health-and-wellness/getting-the-covid-19-vaccine
Terre-Neuve et Labrador : https://www.gov.nl.ca/covid-19/vaccine/gettheshot/#second-booster
Nunavut : https://www.gov.nu.ca/health/information/covid-19-vaccination
Territoires du Nord-Ouest : https://www.nthssa.ca/en/services/coronavirus-disease-covid-19-updates/covid-vaccine
Yukon : https://yukon.ca/en/vaccine-questions#booster-vaccines
Pour obtenir une autorisation d’urgence comme ce fut le cas pour les vaccins contre la COVID-19, les sociétés pharmaceutiques devaient démontrer que les vaccins étaient sûrs et efficaces, mais pas nécessairement qu’ils empêcheraient également la transmission.
Bien que la prévention de la transmission ne soit pas une exigence pour l’approbation des vaccins contre la COVID-19, il a été démontré depuis que les vaccins contribuent à prévenir la transmission virale. Bien que les premiers vaccins contre le SARS-CoV-2 aient pu prévenir la transmission de manière assez efficace, le virus a muté et est devenu plus insensible (ce qui signifie qu’il était de plus en plus difficile pour les vaccins (ou les infections antérieures) d’arrêter la transmission). Cela dit, les vaccins se sont révélés très efficaces pour prévenir la forme grave de la maladie et les décès, qui sont les fonctions les plus importantes des vaccins, ce qui a un impact énorme sur la santé publique.
Toutefois, la transmission étant toujours possible, il est important de rester chez soi quand on ne sent pas bien et de porter un masque si l’on est malade et que l’on doit sortir, afin de ne pas transmettre le virus à d’autres personnes.
À l’heure actuelle, les vaccins sont approuvés, disponibles et recommandés pour les enfants de six mois à cinq ans, ainsi que pour les enfants de cinq ans et plus.
Les vaccins à ARNm originaux et le Nuvaxovid de Novavax original ont été associés à un risque rare de myocardite/péricardite. Les données ne sont pas encore disponibles pour les vaccins XBB.1.5.
Toutefois, dans les données recueillies lors des précédentes campagnes de vaccination, les cas de myocardite/péricardite ont été rares. Le gouvernement du Canada a également déclaré que « les données relatives aux vaccins contre la COVID-19 bivalents et à ARNm original dans différentes tranches d’âge montrent que le risque de myocardite est plus faible après une dose de rappel qu’après la deuxième dose de la série primaire, et qu’aucune différence spécifique au produit dans le risque de myocardite n’a été identifiée après une dose de rappel à l’heure actuelle, y compris chez les adolescents âgés de 12 à 17 ans ».
Il est également important de noter que l’incidence de myocardite et de péricardite s’est avérée plus élevée chez les personnes non vaccinées par rapport à celles qui ont été vaccinées.
De plus amples informations sur la séroprévalence et les effets de la COVID-19 chez les enfants et les adolescents sont disponibles dans cette Synthèse de recherche du secrétariat du GTIC.
L’infection par le SARS-CoV-2 pendant la grossesse est associée à un risque accru d’hospitalisation, d’admission aux soins intensifs, de naissance prématurée, de faible poids de naissance et d’admission à l’unité de soins intensifs néonatals. La vaccination pendant la grossesse n’augmente pas le risque d’issue défavorable de la grossesse ou de l’accouchement, y compris la fausse couche, la mortinaissance, l’insuffisance pondérale à la naissance, la naissance prématurée et l’admission à l’unité de soins intensifs néonatals. En fait, la vaccination contribue à réduire ces risques.
Il est particulièrement recommandé aux personnes enceintes de se faire vacciner, de préférence avec un vaccin à ARNm, car les données disponibles sur l’innocuité de ce type de vaccin dans cette population sont plus nombreuses. On peut être vacciné à n’importe quel stade de la grossesse.
Il a été démontré que les taux d’effets indésirables liés aux vaccins sont similaires chez les personnes enceintes ou allaitantes et chez celles qui ne le sont pas. Les études n’ont pas mis en évidence d’impact des vaccins à ARNm contre la COVID-19 sur le nourrisson/l’enfant nourri au lait humain, ni sur la production ou l’excrétion de lait.
Il existe un Registre canadien des vaccins contre la COVID-19 pour les personnes enceintes et allaitantes, hébergé par l’Université de la Colombie-Britannique et financé par le Groupe de travail sur l’immunité face à la COVID-19 (GTIC) afin d’évaluer la sécurité et l’efficacité des vaccins contre la COVID-19.
Pour en savoir plus sur la vaccination pendant la grossesse, consultez la Synthèse de recherche du secrétariat du GTIC.
Les personnes modérément ou gravement immunodéprimées (c’est-à-dire celles dont le système immunitaire est affaibli) courent un risque accru de contracter la maladie et de mourir de la COVID-19. Le Gouvernement du Canada recommande à ces personnes en particulier de rester à jour dans leur vaccination contre la COVID-19. Cela comprend, dans certains cas, au moins trois doses dans la série de primo-vaccination ainsi que des doses de rappel.
On a constaté qu’une troisième dose de vaccin améliorait l’immunité chez de nombreux patients atteints de maladies inflammatoires à médiation immunitaire (MIMI) (1-3). L’efficacité de la vaccination et les réponses immunitaires provoquées chez les patients atteints de MIMI dépendent de facteurs tels que l’âge, les comorbidités et les traitements immunomodulateurs. Chez les greffés partiellement ou totalement vaccinés et infectés par Omicron, les réponses immunitaires étaient comparables à celles de personnes au système immunitaire sain qui avaient été vaccinées trois fois (cela dépendait de leur âge et des traitements qu’elles recevaient) (4). Cela suggère que les vaccins contre la COVID-19 provoquent une forte immunité protectrice chez les personnes immunodéprimées (4).
Le GTIC a financé de nombreuses études portant sur la sécurité et l’efficacité des vaccins chez les personnes atteintes du VIH, de maladies inflammatoires de l’intestin et d’arthrite inflammatoire, de maladies rénales chroniques, de greffes d’organes pleins et chez les personnes atteintes ou traitées pour un cancer. Pour en savoir plus sur les résultats de cette recherche financée par le GTIC, consultez la Synthèse de recherche du secrétariat du GTIC ici.
- Cheung MW, Dayam RM, Law JC, Goetgebuer RL, Chao GYC, Finkelstein N, Stempak JM, Pereira D, Croitoru D, Acheampong L, Rizwan S, Lee JD, Ganatra D, Law R, Delgado-Brand M, Mailhot G, Piguet V, Silverberg MS, Watts TH, Gingras A-C, Chandran V. Third dose corrects waning immunity to SARS-CoV-2 mRNA vaccines in immunocompromised patients with immune-mediated inflammatory diseases. RMD Open. doi: https://doi.org/10.1136/rmdopen-2022-002622.
- Quan J, Ma C, Panaccione R, Hracs L, Sharifi N, Herauf M, Makovinović A, Coward S, Windsor JW, Caplan L, Ingram RJM, Kanji JN, Tipples G, Holodinsky JK, Bernstein CN, Mahoney DJ, Bernatsky S, Benchimol EI, Kaplan GG ; STOP COVID-19 in IBD Research Group. Serological responses to three doses of SARS-CoV-2 vaccination in inflammatory bowel disease. 2023 Apr;72(4):802-804. Doi: https://doi.org/10.1136/gutjnl-2022-327440.
- Windsor JW, Caplan L, Ingram RJM, Charlton C, Kanji JN, Tipples G, Holodinsky JK, Bernstein CN, Mahoney DJ, Bernatsky S, Benchimol EI, Kaplan GG; STOP COVID-19 in IBD Research Group. Serological responses to three doses of SARS-CoV-2 vaccination in inflammatory bowel disease. Lancet Gastroenterol Hepatol. 25 oct. 2022:S2468-1253(22)00340-5. doi : https://doi.org/10.1016/S2468-1253(22)00340-5.
- Ferreira VH, Solera JT, Hu Q, Hall VG, Arbol BG, Rod Hardy W, Samson R, Marinelli T, Ierullo M, Virk AK, Kurtesi A, Mavandadnejad F, Majchrzak-Kita B, Kulasingam V, Gingras AC, Kumar D, Humar A. Homotypic and heterotypic immune responses to Omicron variant in immunocompromised patients in diverse clinical settings. Nat Commun. 4 août 2022;13(1):4489. doi: https://doi.org/10.1038/s41467-022-32235-x.
En mars 2024, on peut supposer que la plupart des individus ont été exposés à la COVID-19. À ce titre, le Comité consultatif national de l’immunisation (CCNI) qui met à jour ses recommandations plusieurs fois par an, recommande à tous les Canadiens âgés de plus de six mois de recevoir une dose de rappel avec la dernière souche sélectionnée à l’automne 2024. Voir leurs orientations pour l’automne 2024 ici.
Les personnes qui ont été infectées par le SARS-CoV-2 peuvent attendre six mois après leur infection pour recevoir la dose de rappel, bien qu’un intervalle minimum de trois mois se soit également avéré efficace.
La vaccination est l’un des meilleurs outils pour limiter la forme grave de la maladie.

Surveillance des vaccins
Les études portant sur la surveillance des vaccins se penchent sur l’efficacité des vaccins (leur capacité à prévenir la forme grave de la maladie grave, les nouvelles infections et la transmission) et sur leur sécurité (identification et quantification des effets indésirables des vaccins). Un effet indésirable est un effet nocif non désiré résultant d’un médicament ou d’une autre intervention.
La surveillance des vaccins s’intéresse également de manière plus précise à la réponse immunitaire générée par le vaccin : dans quelle mesure le vaccin parvient-il à produite une réponse immunitaire protectrice, quels sont les détails de la réponse immunitaire induite par le vaccin, pendant combien de temps ces « marqueurs de protection » peuvent-ils être détectés, et pendant combien de temps le vaccin sera-t-il efficace.
La surveillance des vaccins porte sur la confiance envers les vaccins, ce qui permet d’étudier les facteurs à l’origine des craintes que les gens peuvent avoir à l’égard de la vaccination (également connues sous le nom d’hésitation à l’égard de la vaccination).
Parmi les études financées par le GTIC figurent l’évaluation de l’efficacité de différentes combinaisons de vaccins, la vaccination chez les femmes enceintes et les enfants, la vaccination chez les personnes présentant un risque plus élevé en raison d’autres problèmes de santé, et l’efficacité des vaccins pour la prévention des résultats cliniques graves chez les adultes hospitalisés.
Le GTIC a financé plusieurs études de recherche qui ont évalué la sécurité des vaccins. La sécurité des vaccins est évaluée par le suivi des effets secondaires suivant l’immunisation (ESSI), y compris un lien avec l’anaphylaxie et d’autres événements allergiques, le syndrome de Guillain-Barré, la paralysie de Bell, et la maladie améliorée associée à la vaccination, entre autres.
Certaines études financées par le GTIC documentent des problèmes de santé, y compris des réactions temporaires locales au point d’injection, des symptômes systémiques (fièvre, fatigue, myalgie), des symptômes respiratoires évoquant un rhume ou une grippe, et des symptômes gastro-intestinaux (nausées, vomissements, diarrhée ou douleurs d’estomac), entre autres. Les populations étudiées recoupent des études mesurant l’efficacité des vaccins et comprennent des femmes enceintes, des enfants, des personnes présentant un risque plus élevé en raison d’autres problèmes de santé et des adultes hospitalisés.

COVID longue
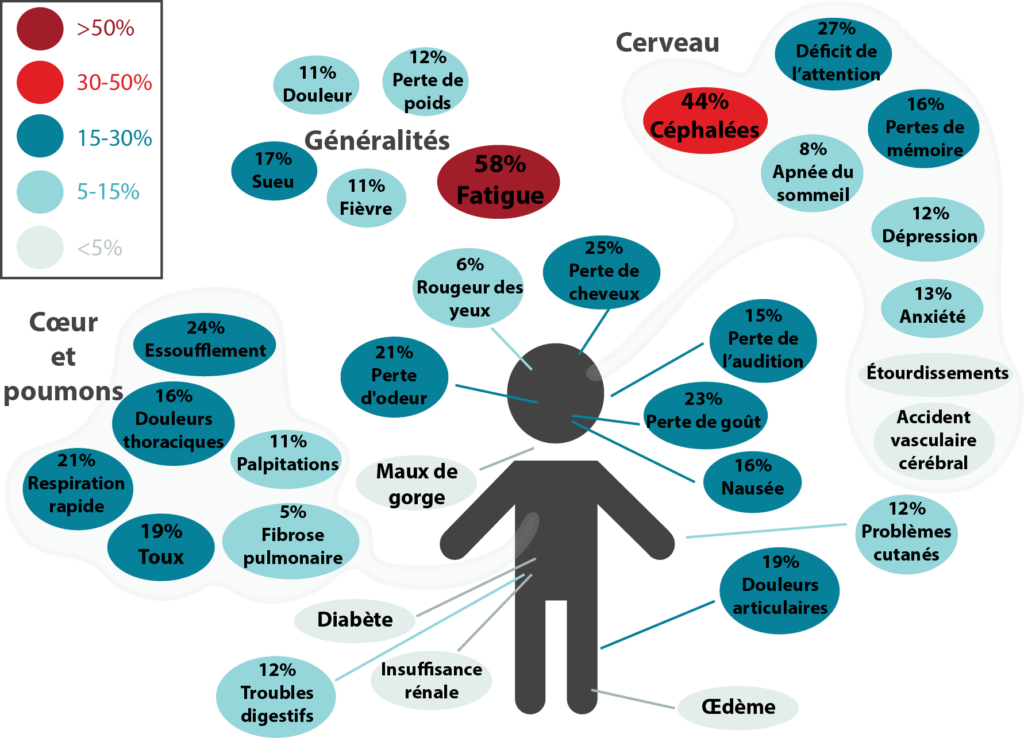
Figure 3.1. Effets à long terme de COVID-19. Ce diagramme a été adapté d’une méta-analyse réalisée par Lopez-Leon et al. et montre le pourcentage pour chaque symptôme à long terme de la COVID-19. Les symptômes ont été classés en trois catégories : symptômes généraux, symptômes cérébraux, symptômes cardiaques et pulmonaires. Les symptômes les plus fréquents étaient la fatigue, les maux de tête, les troubles de l’attention, la perte de cheveux et l’essoufflement.
La COVID longue, également connue sous le nom d’affections post-COVID (APC), désigne le large éventail de symptômes et d’affections dont souffrent certaines personnes quatre semaines ou plus après une première infection par le SARS-CoV-2, le virus responsable de la COVID-19. L’Organisation mondiale de la santé définit les APC comme « les symptômes et les complications médicales qui persistent, réapparaissent ou émergent 12 semaines après la phase initiale d’infection aiguë ». (Figure 3.1)
La COVID longue est un terme générique qui fait référence à un groupe de troubles qui peuvent se manifester après une infection par le SARS-CoV-2. Pour qu’une personne soit considérée comme atteinte de la COVID longue, les symptômes doivent être nouveaux (après l’infection), persistants ou récurrents pendant des semaines, des mois, voire des années. Il s’agit de problèmes respiratoires, neurologiques, psychologiques et cardiaques. Les symptômes les plus courants sont la fatigue, l’essoufflement et le dysfonctionnement cognitif, ou « brouillard cérébral ». Les symptômes peuvent apparaître après une convalescence due à la COVID-19 ou persister depuis la maladie initiale. Ils peuvent également fluctuer ou réapparaître au fil du temps. Ces symptômes peuvent perturber considérablement la vie de certaines personnes, les empêchant d’effectuer des activités quotidiennes ou de marcher sur de courtes distances.
Bien que la COVID longue survienne le plus souvent chez les personnes ayant été atteintes d’une infection grave à la COVID-19, il n’est pas limité à ce groupe de personnes. Les autres groupes à risque sont les personnes non vaccinées, les femmes, les fumeurs, les personnes souffrant de problèmes de santé sous-jacents et les personnes âgées, en particulier celles qui sont fragiles.
En mars 2024, on estime qu’environ 17 % des patients atteints de la COVID-19 développeront une COVID longue.
Les recherches sur les causes de la COVID longue se poursuivent et portent sur la réactivation potentielle d’un virus latent, une réponse auto-immune, des lésions organiques ou des restes de virus vivant dans les tissus. Selon la directrice de l’Institut national de la santé, la Dre Monica Bertagnolli, les données disponibles au printemps 2024 suggèrent que les vaccins jouent un rôle clé dans la prévention de la COVID longue.
Le GTIC a financé quelques études sur la COVID longue dont une réalisée par Statistique Canada et intitulée Enquête canadienne sur la santé et les anticorps contre la COVID-19 (ECSAC) – Cycle 2.
Lire une synthèse de recherche sur la COVID longue du secrétariat du GTIC de février 2022.
Voir les résultats individuels de la Recherche financée par le GTIC sur la COVID longue.

Séroprévalence et sérosurveillance
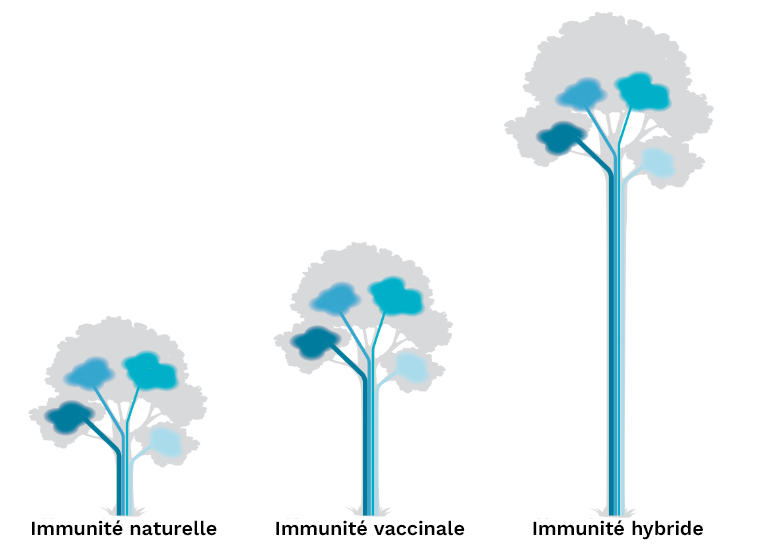
Figure 4.1. Représentation visuelle de l’immunité hybride observée chez les plantes. Connue sous le nom de « vigueur hybride », elle se manifeste lorsque différentes lignées de plantes sont croisées et que l’hybride est une plante beaucoup plus résistante. Il en va de même lorsque l’immunité naturelle est combinée à l’immunité vaccinale, ce qui se traduit par des réponses anticorps 25 à 100 fois plus élevées, sous l’impulsion de lymphocytes B mémoires et de lymphocytes T CD4+, et par une protection croisée plus large contre les variants (1).
- Shane Crotty. Hybrid immunity. Science. 2021; 372,1392-1393. doi: 10. 1126/science.abj2258.
La séroprévalence est le nombre (ou le pourcentage) de personnes qui, dans une population, présentent des anticorps spécifiques contre un virus ou un agent infectieux, d’après des tests sanguins. Par exemple, si la séroprévalence est de 1 %, 1 % de la population étudiée possède des anticorps contre le virus ou l’agent infectieux. Les anticorps détectés peuvent être attribuables à une infection antérieure ou à une vaccination.
La sérosurveillance fournit des estimations des niveaux d’anticorps (dans des échantillons de sang) contre des agents infectieux, tels que le SARS-CoV-2, dans un grand groupe de personnes.
Il s’agit de l’étalon-or pour mesurer l’immunité de la population face aux infections ou aux vaccins. Une sérosurveillance efficace, associée à d’autres données épidémiologiques clés telles que les hospitalisations, les taux de mortalité et la couverture vaccinale, aide les responsables de la santé publique à élaborer des lignes directrices raisonnables en matière de santé publique. Lorsque l’on sait combien de personnes possèdent des anticorps pour se prémunir contre une infection potentielle, ou du moins contre des formes graves d’infection, les responsables de la santé publique peuvent informer et protéger la population avec plus d’assurance.
Pour comprendre l’immunité de la population face au SARS-CoV-2, des échantillons de sang de dizaines de milliers de Canadiens ont été analysés pour vérifier les niveaux d’anticorps dirigés contre les protéines du SARS-CoV-2 et le GTIC a combiné les données. Chaque mois, le GTIC envoyait un rapport à l’administrateur en chef de la santé publique du Canada et mettait à jour sa page Web Séroprévalence au Canada avec les dernières estimations de séroprévalence.
L’immunité « naturelle », que nous préférons appeler immunité acquise par l’infection, désigne la défense développée contre le SARS-CoV-2 à la suite d’une infection ou d’une exposition – et non à la suite d’un vaccin.
L’immunité acquise par une vaccination désigne le mécanisme de défense de l’organisme contre un virus créé en réponse à un vaccin.
L’immunité hybride, comme son nom l’indique, est une combinaison d’immunité acquise par l’infection et d’immunité acquise par la vaccination, et tend à présenter une réponse immunitaire plus importante.
Des données sont encore en cours de collecte sur la durée de vie de chacune de ces immunités, ou de leurs combinaisons. De nombreux facteurs influencent la force de la réponse immunitaire d’un individu.

Comprendre les anticorps
Lorsque notre organisme détecte la présence d’une protéine étrangère ou « jamais vue », comme une protéine virale, il fabrique des anticorps. Les anticorps sont des protéines spécifiques produites par le système immunitaire pour reconnaître et se lier à ces substances « étrangères » (antigènes) et les éliminer de l’organisme.
Ce processus fait partie d’une réponse immunitaire saine et est à la base de l’effet protecteur des vaccins. Des anticorps peuvent être détectés dans le sang des personnes récemment infectées et vaccinées. Dans de nombreux cas, ils sont détectés longtemps après l’exposition initiale.
Les anticorps sont également appelés immunoglobulines, abrégées en Ig, et se présentent sous différents sous-types : IgA, IgM, IgG, IgE et IgD. L’IgM est la première à être fabriquée en réponse à une protéine étrangère et elle peut être présente dans le sang pendant une courte période après l’exposition à l’antigène. Les anticorps IgG apparaissent un peu plus tard, mais peuvent être détectés plus longtemps. Les vaccins conçus contre la COVID-19 approuvés et autorisés au Canada produisent principalement des anticorps IgG reconnaissant la protéine de spicule des variants et sous-variants du SARS-CoV-2.
La liaison des anticorps est hautement spécifique. Les anticorps ne peuvent pas se lier à n’importe quelle protéine, mais uniquement à leur cible. La force et la spécificité de leur liaison sont à la base de plusieurs de leurs rôles importants : ils peuvent alerter plusieurs branches du système immunitaire d’une infection en cours et marquer les protéines étrangères (et par conséquent le virus qui y est attaché) pour qu’elles soient ingérées par les cellules immunitaires et détruites.
Un type unique d’anticorps, appelé anticorps neutralisants, reconnaît les protéines étrangères et les empêche de se lier aux récepteurs cellulaires, bloquant ainsi l’entrée du virus dans les cellules humaines. Pour les vaccins contre le SARS-CoV-2, c’est la protéine du spicule (S) qui est visée.
Les protéines de spicule (S) constituent la couche externe du virus. Ce sont elles qui donnent aux virions (les particules infectieuses virales) l’apparence d’une couronne. Les protéines de spicule sont responsables de la liaison avec le récepteur cellulaire, un événement nécessaire pour que le virus pénètre dans la cellule humaine. Les vaccins contre la COVID-19 ont été conçus contre la protéine du spicule.
La protéine de spicule (S), qui recouvre la couche externe du virus, et la protéine de la nucléocapside (N), qui enveloppe et protège le composant génomique du virus, sont les plus ciblées par le système immunitaire.
Les vaccins contre la COVID-19 disponibles au Canada et dans la plupart des autres pays ont été conçus contre la protéine S. Les anticorps reconnaissant la protéine S sont appelés IgG antispiculaires. De même, les anticorps reconnaissant la protéine N sont appelés IgG anti-nucléocapside et leur détection suggère une infection antérieure par le SARS-CoV-2, car la vaccination ne produit que des IgG anti-S.
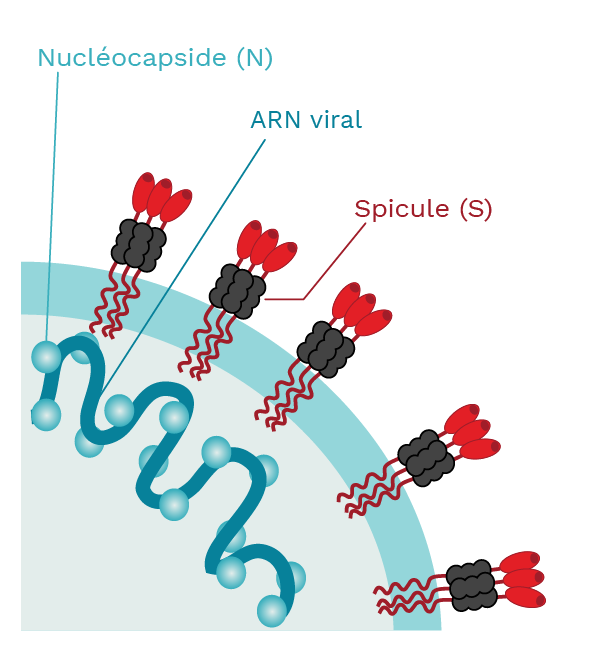 |
Le SARS-CoV-2 possède les protéines de spicule (S) qui recouvrent la surface de la membrane externe. Ces protéines S se lient à un récepteur appelé enzyme de conversion de l’angiotensine 2 (ECA2). La protéine de la nucléocapside (N) forme des complexes avec l’ARN viral et participe à la réplication virale. Crédit photo : Mariana Bego. |

Dépistage du SARS-CoV-2
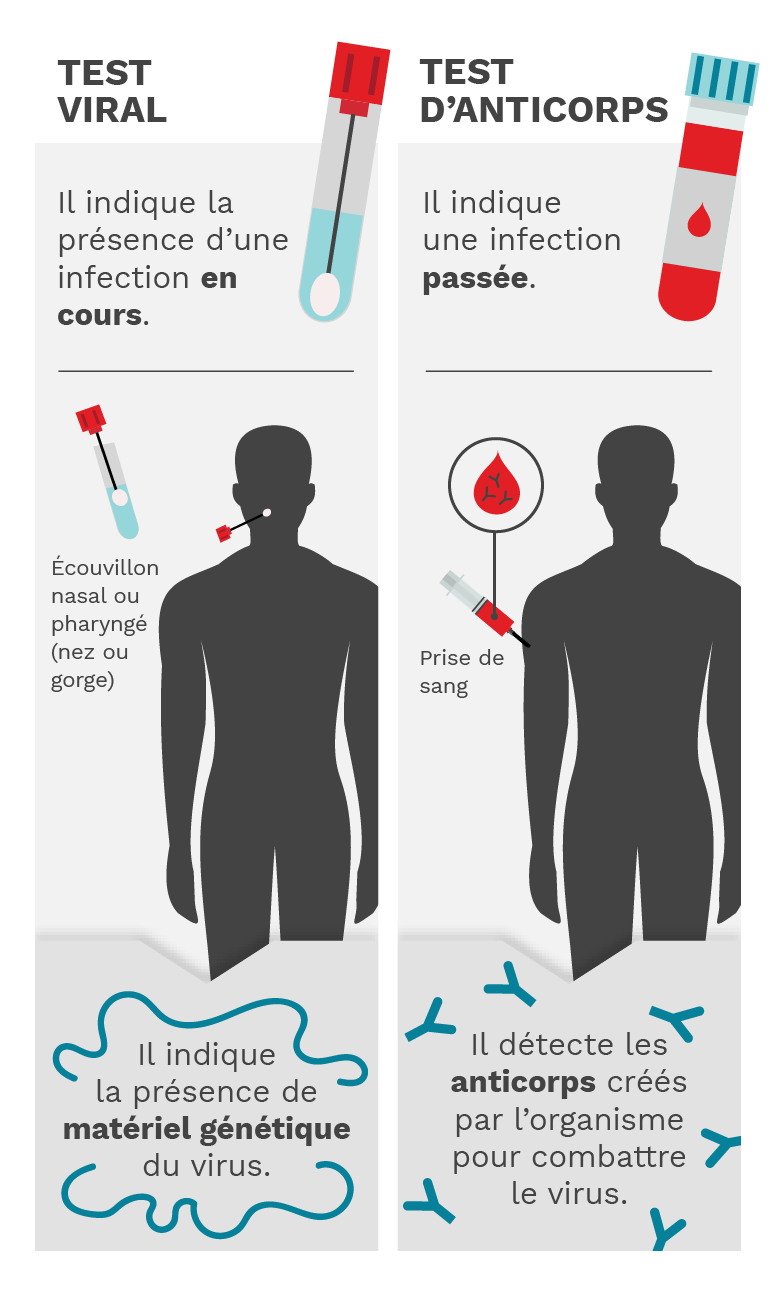
Figure 5.1. Le test viral consiste à prélever un échantillon de nez ou de gorge et à détecter la présence du matériel génétique du virus, ce qui permet de savoir si l’on est en présence d’une infection active. Le test d’anticorps consiste en une prise de sang qui permet de détecter les anticorps créés par l’organisme pour lutter contre le virus. Cela vous permet de savoir si vous avez été infecté dans le passé. Crédit photo : Mariana Bego.
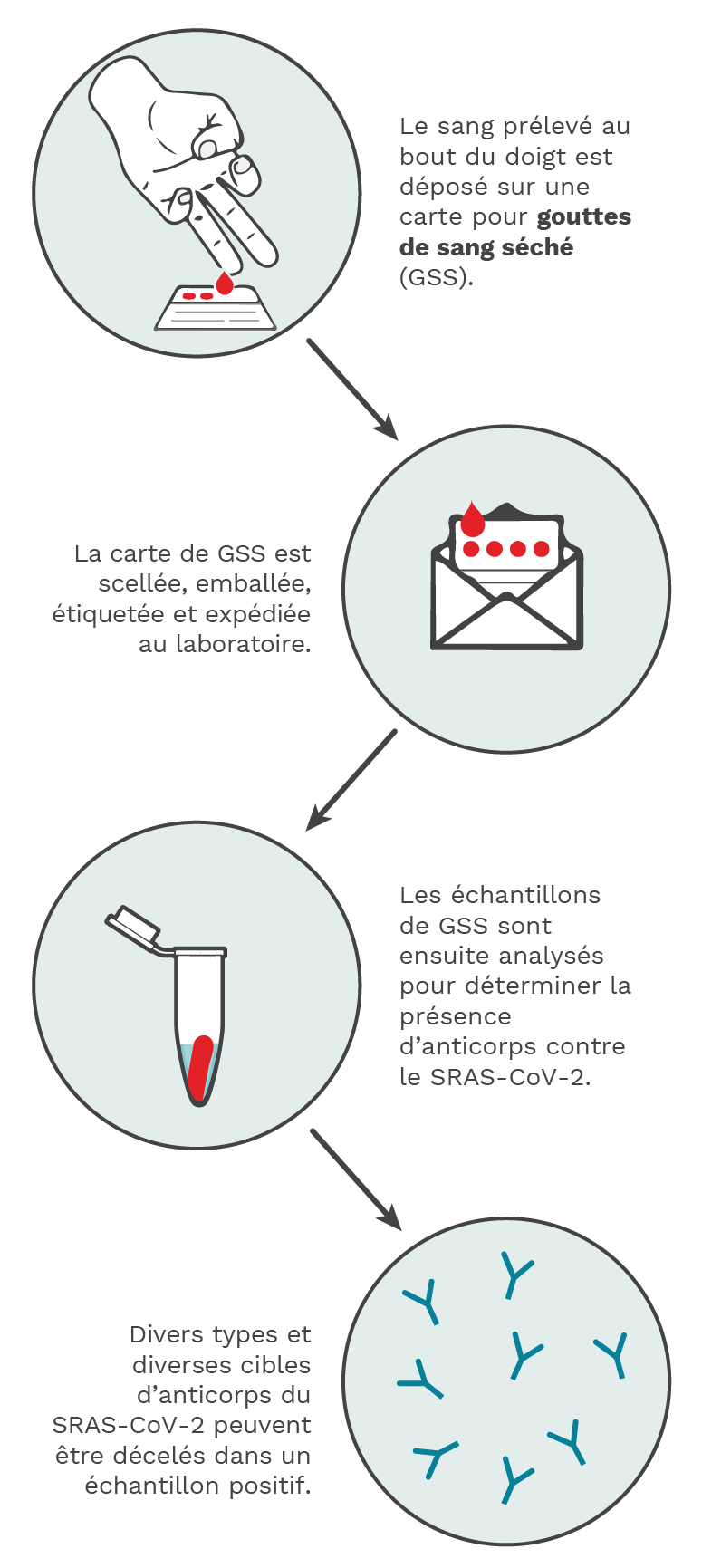
Figure 5.2. À l’aide d’une lancette à ressort fournie dans la trousse de dépistage, des gouttes de sang provenant d’une piqûre du doigt sont déposées sur la carte de papier filtre de GSS. La carte de GSS est ensuite scellée, emballée, étiquetée et expédiée à un laboratoire d’analyse, où il est traité et analysé pour détecter la présence d’anticorps contre le SARS-CoV-2. Un résultat positif indiquerait une infection passée. Crédit photo : Kristin Davis.
Voir une VIDÉO explicative.
Un test viral, également appelé test de diagnostic, peut vous indiquer si vous avez une infection active par le SARS-CoV-2, ce qui vous obligerait à prendre des mesures pour vous isoler afin d’éviter de contaminer d’autres personnes.
Le test est souvent réalisé à partir d’échantillons prélevés dans le nez ou la gorge, car ces zones sont les plus susceptibles de contenir suffisamment de virus pour être détectées. Un test positif indique une infection active. Des tests salivaires sont également possibles. Une fois l’infection résolue, le test donne un résultat négatif.
Plus précisément, le test lui-même recherche la présence du matériel génétique du virus. Dans le cas du SARS-CoV-2, le virus responsable de la COVID-19, ce matériel génétique est l’ARN.
L’obtention d’un résultat négatif lors d’un prélèvement de gorge ou de nez ou d’un test salivaire (test viral) ne signifie pas qu’une personne n’a jamais eu la COVID-19. Cela signifie que la personne n’est pas infectée par le virus actuellement, ou que le virus n’est plus présent dans le mucus du nez ou de la gorge, ou que le virus est si peu présent qu’il ne peut pas être détecté par le test.
Un test viral peut vous indiquer si vous êtes actuellement infecté par le SARS-CoV-2, tandis qu’un test d’anticorps peut vous indiquer si vous avez eu une infection ou si vous avez réagi à une vaccination dans le passé en produisant des anticorps contre les protéines virales. La recherche d’anticorps peut être utilisée pour différencier l’immunité acquise par l’infection de l’immunité induite par le vaccin. Par exemple, une personne précédemment infectée par le SARS-CoV-2 aura des anticorps reconnaissant les protéines virales (souvent testés comme des anticorps reconnaissant les protéines virales du spicule et de la nucléocapside), alors qu’une personne ayant reçu un vaccin contre la COVID-19 n’aura que des anticorps reconnaissant le spicule, mais pas la nucléocapside. En effet, les vaccins contre la COVID-19 disponibles en Amérique du Nord ont été conçus en utilisant uniquement la protéine de spicule du SARS-CoV-2. (Figure 5.1)
Les tests PCR permettent de déterminer une infection active en identifiant le matériel génétique du SARS-CoV-2 (ARN) à partir d’un écouvillon nasal ou pharyngé ou d’un échantillon de salive. Le test PCR doit généralement être effectué par un professionnel de la santé, car il est réalisé en laboratoire.
Les tests antigéniques permettent de déterminer une infection active (moins sensible que le test PCR) en identifiant la présence de morceaux de protéines SARS-CoV-2 dans un écouvillon nasal ou pharyngé. Des tests antigéniques à domicile ont été mis au point au cours de la pandémie et ont été le plus souvent effectués à la maison.
Les tests d’anticorps (sérologie) permettent de déterminer une infection passée en identifiant les anticorps contre le SARS-CoV-2 à partir d’un échantillon de sang. Ces échantillons de sang peuvent être prélevés à l’aide d’une aiguille (généralement dans un hôpital, une clinique ou une collecte de sang) ou par le biais d’un test de sang séché (mis au point pendant la pandémie avec l’aide du GTIC pour permettre aux personnes de prélever elles-mêmes des échantillons de sang à domicile).
Les tests antigéniques rapides à domicile de dépistage de la COVID-19 sont devenus plus courants en l’absence de tests PCR généralisés. Ils sont appelés tests antigéniques parce qu’ils détectent les antigènes, des protéines spécifiques qui composent le virus du SARS-CoV-2, au lieu de détecter le matériel génétique (ARN) comme le font les tests PCR. Ils fournissent également des résultats en moins d’une heure, d’où le terme « rapide ».
La sensibilité d’un test rapide à l’antigène, définie comme sa capacité à détecter le virus lorsqu’il est présent, dépend de la charge virale de l’individu. La charge virale, c’est-à-dire la quantité de virus dans les fluides nasopharyngés et le sang, est plus élevée au début de l’infection, lorsque le virus se réplique de manière exponentielle. La charge virale est principalement détectable au cours des cinq premiers jours des symptômes. Après cette période initiale, la performance du test de dépistage rapide des antigènes diminue rapidement à mesure que la charge virale baisse et que l’infection disparaît.
Des tests antigéniques rapides permettent de détecter les infections en cours, y compris celles causées par Omicron. Ils ne peuvent cependant pas dire si une personne a déjà été infectée par le SARS-CoV-2. La vaccination contre la COVID-19 n’interfère pas avec la capacité du test à détecter une infection en cours.
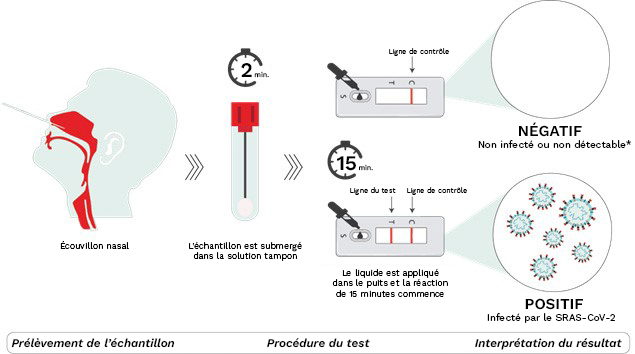
Représentation schématique des tests antigéniques rapides de dépistage de la COVID-19 disponibles au Canada.
Étape 1 – Prélèvement d’échantillons
Un échantillon nasal est prélevé à l’aide de l’écouvillon stérile fourni. Se moucher avant de procéder à l’écouvillonnage, incliner la tête de 70 degrés vers l’arrière, comprimer la narine à l’aide des doigts et effectuer des mouvements circulaires à l’intérieur de la cavité nasale sont autant d’éléments connus pour faciliter le prélèvement.
Étape 2 – Procédure de test
L’écouvillon est immergé dans une solution tampon pour extraire le virus du SARS-CoV-2 (s’il est présent). Après une période de repos, le liquide obtenu est distribué à l’aide d’une buse dans le puits d’échantillonnage du dispositif. L’échantillon se déplace ensuite dans le dispositif, au cours duquel les antigènes présents dans l’échantillon se lient aux anticorps présents dans le dispositif, formant ainsi des complexes antigène-anticorps. La réaction dure de 15 à 30 minutes (selon les instructions du fabricant), après quoi les résultats peuvent être lus.
Étape 3 – Interprétation des résultats
Deux lignes détectées aux lignes T (test) et C (contrôle) de la fenêtre de test indiquent un résultat positif. Cela signifie que l’échantillon est positif pour le SARS-CoV-2 et que la personne est très probablement infectée. Si une seule ligne à C (contrôle) apparaît, le résultat est négatif, ce qui signifie que la personne n’est probablement pas infectée.
Il est important de noter qu’un résultat négatif peut également indiquer qu’une personne est infectée, mais en dessous du seuil de détection. Cela dit, en cas de symptômes, les personnes devraient idéalement continuer à s’isoler pour éviter d’infecter d’autres personnes et suivre les lignes directrices locales en matière de santé publique, le cas échéant. Le test peut être répété quelques jours plus tard pour vérifier à nouveau le statut de l’infection. L’absence de lignes ou une faible ligne T indique que le test n’est pas valide. Un test ne peut être utilisé plus d’une fois.

Autres
Les résultats et les données des études financées par le GTIC sont disponibles à quelques endroits :
- Voir les liens vers toutes les pages présentant les études financées par le GTIC au bas de cette page.
- Voir les résumés simplifiés de tous les résultats de recherches financées par le GTIC disponibles en mars 2024.
- Découvrir les données compilées par le GTIC sur la Séroprévalence au Canada
- Explorer la Banque de données du GTIC, qui poursuit ses travaux, le seul dépôt accessible de données épidémiologiques individuelles sur la COVID-19 au Canada.
Les éléments de données essentiels désignent une liste normalisée de questions formulées par des experts du GTIC et intégrées dans les enquêtes réalisées par des groupes d’étude de l’immunité financés par le GTIC. Ces éléments de données essentiels ont été élaborés pour encourager les nombreux groupes de recherche financés par le GTIC à obtenir et à enregistrer des données d’enquête d’une manière standardisée. L’objectif était que le GTIC puisse comparer directement les résultats des différentes études et initiatives sur la COVID-19 à l’échelle du Canada.
Plus précisément, les éléments de données essentiels comprennent des questions et des réponses relatives au statut de la COVID-19, aux symptômes de la COVID-19, à la qualité du logement, aux facteurs de risque, aux acquisitions de risques, aux vaccins et aux changements de comportement en matière de santé liés au virus.